|
←↑→ 窒素およびリンはどちらも周期律表5Aに属する同族元素である.また,いずれも生物の多量必須元素であるという点でも共通して重要な元素である.しかし,両元素の自然環境中における存在形態や化学的性質には大きな違いがあり,そのような違いは両元素の生物地球化学的循環にも強く反映されている.以下に両元素の違いを列挙する. ・窒素には多様な化学種が存在する.これは窒素の酸化数が−3から+5までさまざまに変化することに由来する.すなわち−3はアンモニア(NH3)であり,+5は硝酸(NO3-)である.しかし,リンはほぼ全量が酸化数+5のリン酸(PO43-)として存在し,化学種としての多様性は小さい.以上のような窒素およびリンの持つ違いは両元素の生物地球化学的循環を大きく異なるものにしている.次にそれぞれの元素について少し詳しく見てみることにする.なお,以下の説明において地表とは大気圏・水圏・生物圏および土壌をさし,火成岩・堆積岩などの岩石圏は含めないものとする.また,有機物は生物遺骸や分解途上の有機物を示し,生物は含まれないものとする.水圏は海洋および湖沼とし,河川は含めない. 2-1 窒素の循環 窒素の循環については,Stevenson(1986)およびJaffe(1992)による概説を参考に要約する. 窒素の存在形態 まず自然界における窒素の主要な存在形態を酸化数の大きい順に見てみることにする. 硝酸(HNO3)および硝酸イオン(NO3-) 酸化数+5.硝酸は気体としても水溶液としても存在できる.硝酸は水溶液中で1価の陰イオン(NO3-)となる.硝酸イオンは陽イオンとイオン対を作り硝酸塩としても存在する.硝酸はカリウム塩(KNO3)およびナトリウム塩(NaNO3)としても採掘されるが,現在ではほとんどがアンモニアの酸化(オストヴァルトのアンモニア酸化法)によって得られている(槌田・内藤, 1972). 二酸化窒素(NO2) 酸化数+4.二酸化窒素は有毒で,一酸化窒素の酸化によって生じる.水に溶解することで硝酸となる.光化学スモッグの原因物質である. 亜硝酸(HNO2)および亜硝酸イオン(NO2-) 酸化数+3.結合する酸素原子が硝酸より一つ少ない.亜硝酸は硝酸と同様,気体としても,イオンとして水溶液中にも存在している. 一酸化窒素(NO) 酸化数+2.燃焼過程において窒素ガス(N2)の酸化によって生成する.工業的にはアンモニアの酸化により生産される.二酸化窒素と同様に有毒で,光化学スモッグの原因物質となっている. 亜酸化窒素(N2O) 酸化数+1.生物による脱窒反応によって生じる.反応性に乏しく,成層圏にまで拡散しオゾン層の破壊に関係しているといわれている. 窒素ガス(N2) 酸化数0.大気の主成分(78%).二つの窒素原子間の三重結合を開くのに大きなエネルギーが必要なために化学的に安定で反応性に乏しい.窒素ガスは大気中に大量に存在するが,現在の地表環境での気圧・温度においては準安定状態であり,平衡状態では硝酸態窒素となる.大気中の窒素ガスは生物による脱窒反応によって生じたものであると考えられている. アンモニア(NH3) 酸化数−3.強い塩基(アルカリ)で,気体としても,水溶液中にアンモニウムイオン(NH4 有機物態窒素 有機物中の窒素の酸化数は−3である.タンパク質を形成するアミノ酸はアミド基(−NH2)を構成要素として必ず持っており,さらに側鎖の構成原子として窒素を含むものもある.また,生物の遺伝子となるDNAの構成単位である核酸中にも窒素が含まれる.また,生物による窒素同化はアミノ酸へのアンモニウムイオン(NH4 窒素の生物地球化学的循環 窒素の生物地球化学的循環について概観すると図2-1のようになる.以下それぞれの過程について図の最上部に位置する大気から,反時計まわりに土壌・水圏へと順に簡潔に述べる. 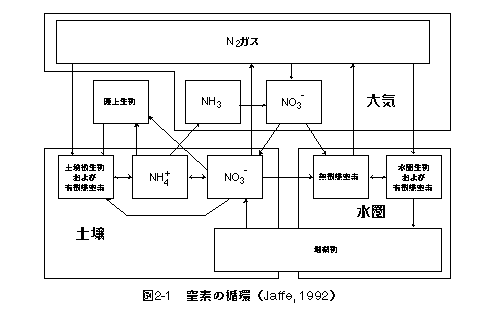 地表に存在する窒素の大部分は大気中の窒素ガス(N2)として存在する.窒素ガスは窒素固定菌により同化され,有機態窒素(酸化数−3)となる. 有機物中の窒素(有機態窒素)はアンモニア化成菌によって分解されアンモニウムイオンとなり,酸化的な環境ではさらに硝酸化成菌によって,亜硝酸を経て硝酸イオンへと変えられる.還元的な環境では逆に硝酸イオンはアンモニウムイオンへと変化する. 還元的な環境でアンモニウムイオン濃度が高いような場合には,気体としてアンモニアが遊離し大気中に揮散する(アンモニアの気化).畜舎や手洗いなどの悪臭はこのアンモニアによるものである.一方硝酸イオンは還元的な環境では脱窒菌によって呼吸に利用され,窒素ガス(N2)あるいは亜酸化窒素(N2O)として大気中に放出される(脱窒). 土壌溶液中のアンモニア態窒素や硝酸態窒素は植物によって根から吸収・同化され,陸上生物の食物連鎖へと入る.生物の遺骸は土壌有機物となり,徐々に分解されて再び無機イオンとなる.こうして窒素は生物−有機物−無機イオンの間を循環する. 硝酸態窒素は溶脱して地表水あるいは地下水中に入る.地表水および水圏に入った窒素は,水中の生物(植物プランクトンや水生植物)によって迅速に吸収され,土壌中と同様に有機態窒素となる.窒素は陸上と同様水圏においても,生物−有機物−無機イオンの間を循環する.さらに脱窒や窒素固定によって大気中の窒素との間で出入りが生じる.有機態窒素の一部は分解されずに沈積し堆積岩となる.海底の隆起などによって岩石中の窒素は再び放出されて硝酸イオンとなる. 大気中の窒素は雷による空中放電や山火事などの燃焼過程によっても酸化されて硝酸態窒素となる.また,水圏からの風送塩としても大気に供給される.大気中の窒素(アンモニアおよび硝酸)は降雨とともに土壌や水圏に入る.この過程が過剰な場合,硝酸態窒素を含んだ酸性雨となる. 2-2 リンの循環 リンについては,Pierrou(1976)および Jahnke(1992)による概説を参考に要約することにする. リンの存在形態 リンはそのほぼ全量がリン酸(酸化数+5)として存在する.したがって,酸化数の違いにより分類することはできず,おもに溶存態・鉱物態・有機態に分類される. 溶存態リン(Dissolved Form) リン酸(H3PO4)が完全に電離した形の陰イオンはリン酸イオン(PO43-)であるが,実際の水溶液中では他の金属イオンの存在や,pHの変化に応じてさまざまな形態で存在する.淡水(蒸留水)はpHが6-7であるので,ほとんどがH2PO4-として存在する.しかし,標準的な海水ではpHが8前後であり,溶解している多くのアルカリ金属イオンと塩を生じ,MgHPO4, NaHPO4-, HPO42-などが卓越する.このように,酸−塩基反応は水溶液中でのリンの反応性に大きな影響を与える.もう一つの重要な水溶態リンの化学種としてはポリリン酸が挙げられる.これはリン酸イオンがP-O-P結合によって重合したものであり,鎖状・環状の化合物である.ポリリン酸の自然水中の濃度は他に比べて低いが,非常に反応性が高く,工業原料や洗剤などとして利用されている. 鉱物態リン(Particulate Form) リンは多くの造岩鉱物中に構成・置換成分として含まれるほか,鉱物表面へ吸着された成分としても存在する.しかし地殻中に存在するリンの大部分(95%)はアパタイト(Ca10(PO4)6X2)として存在する.CaおよびXにはさまざまな元素が入り得る.アパタイトの成因は多様であり,火成岩中にも含まれる(0.02-1.2%)し,生物によっても骨や歯,貝殻として作られる.しかし,地表でもっともリンが集積しているのは堆積物中のアパタイトであり,リン酸(PO43-)の世界総生産量の82%が堆積岩に由来する.グアノ(海鳥の糞が堆積硬化したもので,肥料として利用される)はリン濃度が高く価値も高いが,リン資源全体と比較した場合には無視できるほどの量しか存在しない. 水圏の底に堆積した物質は生物由来のものがほとんどであり,有機物としてリンを含んでいる.生物体中のリンは堆積物中でリン酸イオン(PO43-)として細孔水中に溶出し,生物由来である炭酸カルシウム(CaCO3)のCO32-と置換することで,アパタイトを生成する. 有機態リン(Organic Form) 生物体中に存在する多くの化学物質はリン酸エステル結合を持ち,構成成分としてリン原子を含んでいる.その中でも特に重要なのは以下の4つである. 1)遺伝情報の保持・伝達に関与するもの(DNA, RNA) 2)細胞内のエネルギー代謝に関与するもの(ATP, NADPなど) 3)細胞膜を構成し,生物を外的環境から区画するもの(リン脂質) 4)骨格や外殻を形成し,生物体の体制を維持するもの(アパタイト) 1)から3)までは,有機リン化合物であり,易分解性のリンとして水圏のリン循環の中で大きな役割を果たしている. リンの生物地球化学的循環 リンの生物地球化学的循環を概観すると,図2-2のようになる.以下にそれぞれの過程について簡潔に述べる. 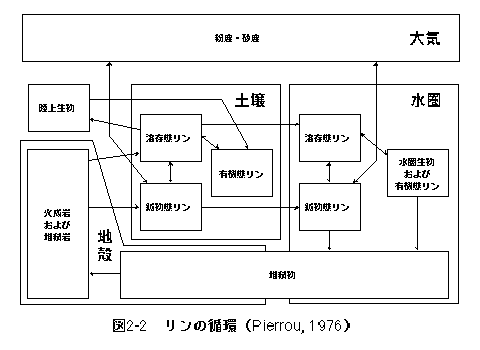 リン循環については依然として不明の点が多いとされているが,主要なルートは火成岩・堆積岩から土壌を経て水圏へと入るものであると考えられている.水圏堆積物に含まれるリンは,海底の隆起によって陸地となり,風化によって再び地表環境中に放出される. 造岩鉱物・リン酸塩として砂や粘土の中に含まれている鉱物態リン(Particulate Phosphate)は,ほとんど他のプールと接触することなく水圏へと運ばれる.しかし,一部は水溶性のイオン(Dissolved Phosphate)となる.リン酸イオンは,土壌粒子の陰イオン交換反応によって吸着されたリン酸や鉄・アルミニウムのリン酸塩と化学的平衡状態にあり,土壌溶液中のリン濃度は通常余り高くない(リン酸塩の溶解度は非常に低い).このため,植物は大量の土壌溶液を根から吸収してリンを体内に取り込む.陸上植物に取り込まれたリンは食物連鎖を経て最終的に土壌有機物(生物遺骸)となる.土壌有機物は徐々に分解されて溶存態リンとなり,再び植物に吸収される.こうしてリンは陸上生物−土壌有機物−土壌溶液の間を循環する. 一方,土壌中のリンは砂や粘土および有機物とともに地表流去水として水圏に入るが,水圏に入ったリンの大部分を占める鉱物態リンはそのほとんどが生物に取り込まれることなく堆積してしまう.しかし,鉱物態リンの一部や易分解性の有機態リンは水中に溶出し,溶存態リンを経て迅速に水圏生物に取り込まれる.こうしてリンは水圏の中で,生物−有機物−溶存態リンとの間を循環する.生物遺骸の一部は沈降して堆積物中に入る. 一方大気中にも微量であるが粉塵・砂塵としてリンが含まれる.これは陸地からの砂塵や水圏からの風送塩に由来するもので,大気中の滞留時間は短く,すぐに陸地あるいは水圏に沈積する. ←↑→ [ Reference ] Jaffe, D. A., "The Nitrogen Cycle", Global Biogeochemical Cycles, Academic Press, 1992, pp. 263-284 Jahnke, R. A., "The Phosphorus Cycle", Global Biogeochemical Cycles, Academic Press, 1992, pp. 301-315 Pierrou, U., "The Global Phosphorus Cycle", Nitrogen, Phosphorus and Sulphur−Global Cycles., SCOPE Report 7., Ecological Bulletins, vol.22, 1976, pp. 23-73 Stevenson, F. J., "The Nitrogen Cycle in Soil: Global and Ecological Aspects", Cycles of Soil −C, N, P, S, Micronutrients−, John Willy & Sons, 1986, pp. 106-154 槌田竜太郎・内藤奎爾, 硝酸, 『平凡社大百科辞典』, vol. 75, 平凡社, 1972, pp. 118-119 |